Метотрексат (МТХ) – препарат иммуносупрессивного действия, который обычно используется для лечения ревматоидного артрита (РА). В редких случаях его применение связано с развитием лимфопролиферативных заболеваний (МТХ-ЛПЗ), в основном, экстранодальной локализации (40–70 % пациентов). При МТХ–ЛПЗ поражения чаще всего обнаруживаются в легких, коже, полости рта, селезенке и крайне редко в печени.
В журнале Surgical Case Reports была опубликована статья с описанием клинического случая ЛПЗ печени, развившегося на фоне приема метотрексата для лечения РА.
Описание клинического случая
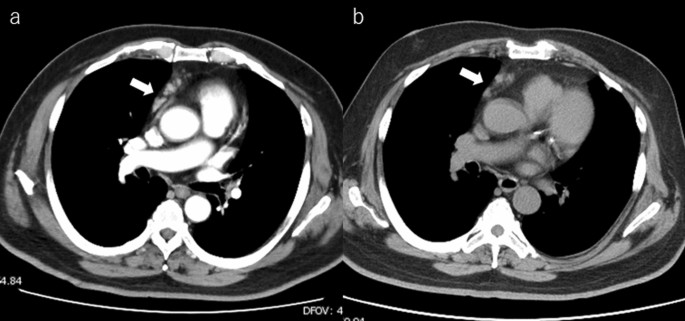
В хирургическое отделение поступил мужчина 66 лет с солитарной опухолью печени. В анамнезе у пациента был РА, по поводу которого он получал МТХ в дозе 14 мг/неделю, эссенциальная гипертензия, бронхиальная астма и дислипидемия. Ранее ему была проведена КТ грудной и брюшной полости в связи с повышенным уровнем С-реактивного белка (СРБ), которая показала увеличение лимфатических узлов средостения и солитарную опухоль печени диаметром 8 см (рис. 1).
Рисунок 1. КТ-снимки средостения, показывающие небольшое увеличение лимфатических узлов при: а) при постановке диагноза; b) спустя месяц после отмены МТХ.
Лечащий врач предположил, что воспалительная реакция и увеличение лимфатических узлов средостения связаны с развитием МТХ-ЛПЗ. Он отменил МТХ, назначил салазосульфапиридин и направил пациента в хирургическое отделение для дальнейшего обследования и лечения опухоли печени. Помимо МТХ, пациент принимал антигипертензивные препараты, ингаляционные кортикостероиды и β-агонисты длительного действия. В анамнезе у пациента отсутствовали гепатит и злоупотребление алкоголем, но он страдал ожирением (ИМТ 34,9 кг/м2). В лабораторных анализах были обнаружены повышенные уровни лейкоцитов (12 600/мкл), СРБ (8,03 мг/дл), лактатдегидрогеназы (ЛДГ) (365 МЕ/мл) и углеводного антигена 19-9 (78,1 МЕ/мл). Содержание печеночных ферментов, общего билирубина, альфа-фетопротеина, белка, индуцированного отсутствием витамина К или его антагонистом-II, и карциноэмбрионального антигена было в норме.
Пациенту была проведена КТ брюшной полости с контрастированием, которая показала кольцевидное гиповаскуляризированное образование d=80 мм в левой латеральной секции печени (рис. 2a–c). Внутрибрюшные лимфатические узлы в малом сальнике и вокруг общих печеночных артерий также были увеличены (рис. 2d).
Рисунок 2. КТ-снимки левой латеральной секции печени с визуализацией гетерогенного гиповаскулярного образования d=80 мм. Стрелкой указан увеличенный лимфатический узел общей печеночной артерии.
МРТ брюшной полости показала гипоинтенсивный сигнал на Т1-ВИ и гиперинтенсивный сигнал на Т2 в границах опухоли, а также высокую интенсивность сигнала на ДВИ. МРТ с контрастированием (Gd-EOB–DAPT) выявила уменьшение накопления гадоксетовой кислоты в гепатобилиарную фазу (рис. 3).
Рисунок 3. МР-снимки опухоли, демонстрирующие гипоинтенсивный сигнал на Т1-изображениях (а), гиперинтенсивный сигнал на T2-изображениях (b), гиперинтенсивный сигнал на ДВИ (с) и низкую интенсивность накопления контраста в гепатобилиарной фазе.
ЭФГДС и колоноскопия не показали каких-либо поражений желудочно-кишечного тракта, поэтому возникло подозрение о наличии внутрипеченочной холангиокарциномы. Через 3 недели после отмены МТХ была выполнена латеральная секционэктомия и лимфаденэктомия. Макроскопический осмотр резецированного участка печени выявил поражения светло-коричневого цвета с неровными границами и множественными белыми узелковыми образованиями (рис. 4).
Рисунок 4. а – Резецированный участок печени; b – Заметны поражение печеночной ткани коричневого цвета, имеющее неровные границы, и белые узелковые образования.
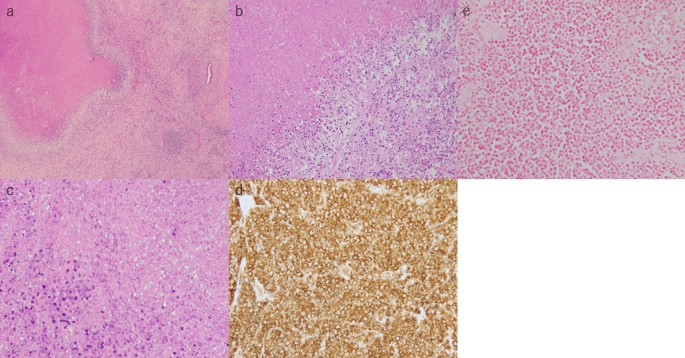
Гистологическое исследование тканей печени позволило обнаружить мелкие круглые клетки, подвергшиеся коагуляционному некрозу и окруженные макрофагами и лимфоцитами (рис. 5 a–c). Жизнеспособных атипичных лимфоцитов выявлено не было. Согласно данным иммуногистохимического исследования, некротические клетки представляли собой CD20-положительные В-лимфоциты (рис. 5d). Малые РНК, кодируемые вирусом Эпштейна-Барра (EBER), не были выявлены (рис. 5e). Тем не менее, сходство с клиническими проявлениями агрессивных лимфом, высокие уровни ЛДГ в сыворотке, увеличение лимфатических узлов средостения и отмена МТХ за 3 недели до поступления позволили поставить диагноз МТХ-ЛПЗ печени.
Рисунок 5. Образец гистологического исследования резецированного участка печени. a–c Мелкие круглые клетки после коагуляционного некроза, окруженные макрофагами и лимфоцитами. Жизнеспособные атипичные лимфоциты отсутствуют. a – ГЭ; ×4; b – ГЭ; ×10; c – ГЭ; ×40. d Образец ИГХ, положительный по CD20 для некротизированных лимфоцитов (CD20; ×40). e Отсутствие EBER в некротизированных лимфоцитах (EBER; ×40).
Патоморфологическое исследование удаленного лимфатического узла не выявило отклонений. Размеры лимфатических узлов средостения через 1 месяц после отмены МТХ не изменились (рис. 1б). Послеоперационный период протекал без осложнений, пациент был выписан на 7-е сутки после вмешательства. При контрольном осмотре через 9 месяцев после операции данных, указывающих на рецидив, не было.
Выводы авторов
Локализация ЛПЗ, ассоциированных с приемом МТХ, различна. Они могут развиться в различных органах, включая печень. Выявление новообразований у пациентов, получавших МТХ для лечения РА, следует рассматривать как показание к биопсии. Тем не менее, у многих пациентов с этой патологией наблюдается спонтанная регрессия опухоли после отмены МТХ.
Справочная информация
Меторексат (MTX) – основной препарат для лечения РА во всем мире. Считается, что его ингибирующее действие на фолатный цикл может повышать риск развития лимфопролиферативных заболеваний (ЛПЗ). Также был описан механизм развития МТХ-ЛПЗ с помощью реактивации вируса Эпштейна-Барр (EBV) вследствие иммуносупрессивного действия МТХ (примерно у 60% пациентов выявляются лабораторные признаки инфицирования EBV). MTX–ЛПЗ имеют более благоприятный прогноз, чем лимфома. Спонтанная регрессия наблюдается в 50–70% случаев после отмены MTX (наличие EBER считается прогностически благоприятным признаком).
MTX–ЛПЗ включают, в основном, экстранодальные поражения, при этом локализация в печени встречается крайне редко. Продолжительность приема МТХ до развития ЛПЗ печени может составлять от 5 месяцев до 17 лет. Наиболее частые симптомы – общая слабость, лихорадка и боль в животе, но почти в половине случаев (40%) клинические проявления отсутствуют.
Данные инструментальных и гистологических исследований, как правило, указывают на лимфому, поэтому важную роль в диагностике играет анамнезе приема МТХ. При подозрении на MTX–ЛПЗ необходимо рассмотреть возможность его отмены и наблюдения за пациентом в течение 2 недель. Если в течение этого периода состояние пациента ухудшается, рекомендовано проведение биопсии и назначение химиотерапии либо хирургическое вмешательство (при солитарных опухолях). В дальнейшем, пациентам с ЛПЗ-МТХ печени требуются контрольные осмотры, так как существует риск рецидива.
Sakamoto, S., Tabuchi, M., Yoshimatsu, R. et al. Hepatic methotrexate-associated lymphoproliferative disease: a case report and literature review. surg case rep 10, 260 (2024). https://doi.org/10.1186/s40792-024-02065-8