Дифференциальная диагностика острых заболеваний брюшной полости может представлять сложную задачу. В журнале Frontiers in Pediatrics был описан клинический случай мультисистемного воспалительного синдрома у ребенка. Его проявления было легко спутать с аппендицитом, а в процессе обследования врачам пришлось удалить увеличенный лимфатический узел брыжейки ободочной кишки.
Описание клинического случая
11-летняя девочка поступила в отделение неотложной помощи с жалобами на ноющую и тупую боль в правой нижней части живота в течение 2-х дней (интенсивность 7/10 баллов), снижение аппетита и повышение температуры до 38°C. При пальпации живота боль усиливалась в его правой нижней части, особенно в точке Мак-Берни. Признаки защитного напряжения мышц или усиление боли при резком отдергивании руки от живота после надавливания отсутствовали.В анамнезе был указан контакт с родственниками, инфицированными COVID-19, примерно за 5 недель до госпитализации. У самой пациентки не было симптомов заболевания, а результаты теста были отрицательными. К текущему моменту она получила 2 дозы мРНК-вакцин Pfizer (за 10 и 6 недель до обращения). Также в анамнезе не было указаний на недавние поездки, контакты с животными, употребление сырой пищи или укусы насекомых.
Пациентке были проведены лабораторные исследования: общий анализ крови (абсолютное число лимфоцитов 330/мкл), общий анализ мочи (лейкоциты 21–30, эритроциты 2+, умеренная протеинурия) и анализ мочи на бакпосев (отсутствие роста патогенных бактерий). Показатели электролитного баланса были в норме. На УЗИ брюшной полости не получилось визуализировать аппендикс из-за скопления газов.
Пациентка была выписана и повторно госпитализирована на следующий день с предполагаемым диагнозом аппендицита вследствие сохраняющихся болей в правом нижнем квадранте живота, лихорадки и усилении боли при пальпации живота. ПЦР-тесты на COVID-19 и грипп типа А и В были отрицательными. В связи с клиническими признаками аппендицита и перитонита была выполнена диагностическая лапароскопия, которая выявила образование размером 8 см, расположенное в области восходящей части брыжейки ободочной кишки вплоть до корня брыжейки. После лапароскопической правосторонней гемиколэктомии признаков перфорации кишечника выявлено не было (рис. 1). После операции был назначен цефтриаксон внутривенно в течение 2 дней до получения результатов посева из брюшины. Проточная цитометрия образцов образования толстой кишки не выявила измененных популяций лимфоидных клеток.
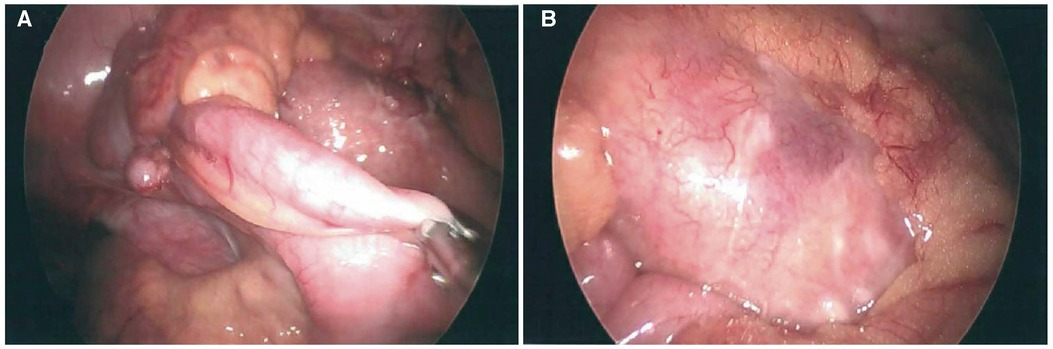
Рис. 1. Лапароскопические изображения неперфорированного аппендикса (А) и воспалительной массы в области брыжейки толстой кишки с сопутствующим фибринозно-гнойным экссудатом (Б).
Послеоперационный период сопровождался постоянной лихорадкой, обширной полиморфной макулопапулезной сыпью (рис. 2), инъекцией конъюнктивы и диареей. ПЦР-тесты показали наличие частиц аденовирусов и респираторно-синцитиального вируса.
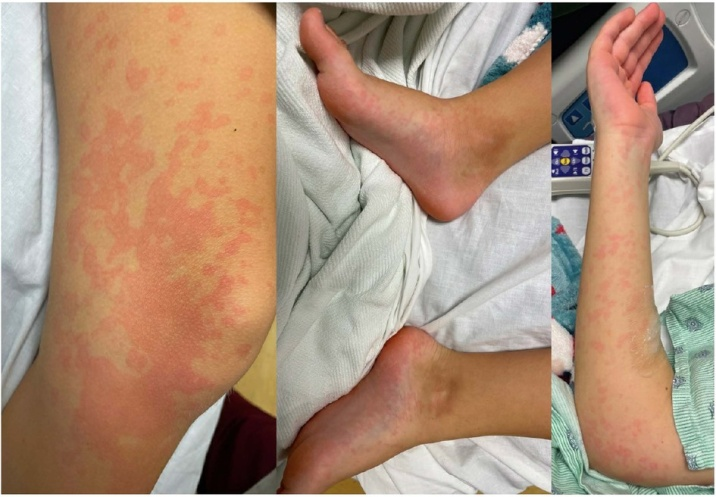
Рисунок 2. Эритематозная пятнистая макулопапулезная сыпь, поражающая туловище и все конечности, включая ладони и подошвы.
Дополнительно были проведены лабораторные исследования крови, которые показали гипоальбуминемию (2,6 г/дл), гипонатриемию (130/ммоль/л), анемию (Hb 8,5 г/дл), лимфопению (абсолютное количество лимфоцитов 180/мм3), тромбоцитопению (146 000/мкл), повышение С-реактивного белка (22 мг/дл), СОЭ (37 мм/ч), прокальцитонина (1,33 нг/мл), ферритина (581 мкг/л), D-димера (2,59 мкг/мл), тропонина (19 нг/л) и наличие IgG к SARS-CoV-2. ЭКГ была без изменений, серологические тесты на вирус Эпштейна-Барра и цитомегаловирус, бактериологический посев крови и кала, а также анализ на токсин C. Difficile были отрицательными.
У пациентки был диагностирован мультисистемный воспалительный синдром (MIS-C), связанный с COVID-19, и назначены иммуноглобулины для внутривенного введения в дозе 2 г/кг и эноксапарин. Кортикостероиды и аспирин были исключены (первые – до получения результатов гистологического исследования образования толстой кишки, а второй – до восстановления толстой кишки после операции). Впоследствии гистологическое исследование показало некротизирующий негистиоцитарный лимфаденит (рис. 3). После начала терапии у пациентки уменьшилась выраженность сыпи, улучшилось общее состояние и лабораторные показатели воспаления. Она была выписана через 48 часов после нормализации температуры тела.
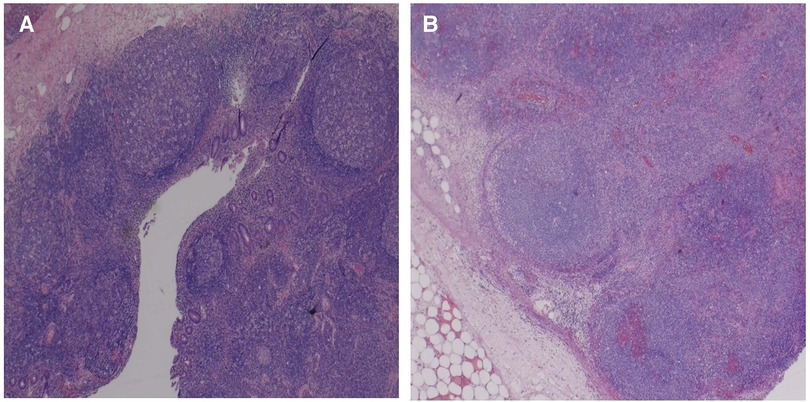
Рисунок 3. Фотографии срезов околокишечной массы, где видны увеличенные лимфатические узлы с прилегающими жировыми тяжами, острым воспалением и отеком (А), а также сохраненной архитектурой, расширенными синусами, обильным кровотечением и зонами некроза (В).
Выводы авторов
Представленный случай демонстрирует процесс дифференциальной диагностики в процессе обследования девочки-подростка с симптомами аппендицита, к которым после операции присоединились кожная сыпь и конъюнктивальная инъекция. Было предположено, что симптомы могли развиться вследствие COVID-19 (MIS-C) или вакцинации против COVID-19 (MIS-V). Развитие некротизирующего негистиоцитарного лимфаденита (болезнь Кикучи-Фудзимото, БКФ) также могло быть связано с вакцинацией против COVID-19 или вирусной инфекцией.
На MIS-C указывали возраст пациентки (БКФ встречается, в первую очередь, у детей младше 5 лет), симптомы поражения кишечника, сходные с таковыми при аппендиците, и лабораторные данные (тромбоцитопения, нейтрофилия, лимфопения, гипонатриемия, повышение уровней D-димера и фибриногена). В то же время, боли в животе могут встречаться и при БКФ, поэтому с учетом результатов гистологического исследования пациентке было назначено лечение этого заболевания.
Отсутствие убедительных доказательств гуморального ответа на вакцину против COVID-19 можно считать ограничением для диагностики MIS-V. Однако, отсутствие в анамнезе рецидивирующих или необычных инфекций, которые могли бы привести к иммунодефициту, и отсутствие иммуносупрессивной терапии значительно снижают вероятность реакции на вакцинацию. Быстрый и положительный ответ на внутривенное введение иммуноглобулина, а также полное выздоровление спустя месяц после начала лечения, подтверждают диагноз MIS-C/V и эффективность выбранной терапии.
Справочная информация
MIS-C/V, связанный с COVID-19, обычно проявляется через 2–6 недель после инфицирования в виде лихорадки и признаков мультисистемного воспаления со стороны сердечно-сосудистой системы и желудочно-кишечного тракта, поражения слизистых оболочек, шока и гематологических изменений. Симптомы MIS-C имеют сходство с проявлениями болезни Кавасаки, синдрома токсического шока и синдрома активации макрофагов. Крайне важно вовремя распознать MIS-C у пациентов с симптомами, указывающими на необходимость хирургического вмешательства на брюшной полости. Такие лабораторные данные, как сниженное или нормальное количество лейкоцитов в крови и тромбоцитопения, могут указать на MIS-C у пациентов с симптомами аппендицита и положительным результатом теста на IgG к COVID-19. В свою очередь, КТ брюшной полости при MIS-C может выявить гепатомегалию, нефромегалию, утолщение стенки желчного пузыря, асцит, мезентериальную лимфаденопатию и повышение эхогенности почек. При подтверждении диагноза аппендицита в сочетании с MIS-C рекомендовано лечение MIS-C до операции.
БКФ – редкая идиопатическая и, как правило, доброкачественная причина гистиоцитарного некротизирующего лимфаденита. Также существует связь между БКФ и аутоиммунными заболеваниями, например, системной красной волчанкой. Заболевание проявляется острым или подострым увеличением лимфатических узлов, обычно в шейном отделе, утомляемостью, головной болью, эритематозной сыпью и гепатоспленомегалией. Лабораторные изменения включают лейкопению, анемию, повышение уровня маркеров воспаления и лактатдегидрогеназы, что ранее приводило к ошибочной диагностике примерно у 30% пациентов с подозрением на лимфому. Диагноз БКФ устанавливается на основании клинического обследования и гистопатологического исследования. При MIS-C поражение лимфатических узлов встречается реже и проявляется, в основном, в виде шейной лимфаденопатии. В литературе описано лишь несколько случаев поражения брыжеечных лимфоузлов при БКФ или MIS-C.
Источник: Bakir M, Iqbal U, Gazal AN and Robertson D (2023) Case Report: Acute abdomen and large mesenteric mass as another face of multisystem inflammatory syndrome in an adolescent child: measure twice, act once!. Front. Pediatr. 11:1324670. doi: 10.3389/fped.2023.1324670.